【化学】ハーバー・ボッシュ法の未来
今回は、ハーバー・ボッシュ法についてです。
ご存知、アンモニアの製造方法。
水と石炭と空気からパンを作る方法
とも呼ばれ、現代社会に不可欠な技術です。
今回は、そのハーバー・ボッシュ法に関連する最新研究を交えつつ、
ハーバー・ボッシュ法の未来を考えたいと思います。
ハーバー・ボッシュ法とは?
アンモニアの工業的製造法。
N2 + 3H2 = 2NH3 + 92kJ
と、窒素と水素からアンモニアを作るものです。
根底にあるのは、ルシャトリエの法則。
熱力学的平衡移動に関する法則。ある熱力学的平衡状態にある系が,外部からの作用で平衡を乱された場合,その作用の効果が弱められる方向にその系の状態が変化するという法則。
ル・シャトリエの法則(ル・シャトリエのほうそく)とは? 意味や使い方 – コトバンク (kotobank.jp)
噛み砕いて説明すると、
化学反応が平衡状態にあるとき、
濃度を増加させると、増やした物質の濃度が減少する方向に平衡が移動
濃度を減少させると、減らした物質の濃度が増加する方向に平衡が移動
圧力、温度などについても同様のことが言えます。
つまり、アンモニアを沢山作るためには
N2 + 3H2 = 2NH3 + 92kJ
の平衡を右側に移動させれば良い。
この式は発熱反応で、分子数は右側の方が少ないから
・温度を低く
・圧力を強く
させてやれば、アンモニアが沢山作れる。
しかし、これには問題があります。
それは、
低温 → 反応速度が低下。時間がかかりすぎる。
高圧 → 高圧に耐えられる設備はコストが高い。
このため現在では、
四酸化三鉄 Fe3O4
を主成分とした触媒を用い、高温高圧下でアンモニアが製造されています。
ハーバー・ボッシュ法がもたらしたもの
化学の授業で置き去りにされがちなのが、ハーバー・ボッシュ法のすごさ。
こうして作られたアンモニアが何に使われるのかというと
化学肥料と硝酸。
化学肥料
アンモニアは窒素化合物です。
植物は窒素をアンモニウムイオンの形で吸収し、成長します。
ハーバー・ボッシュ法を使って作られたアンモニアの実に8割が化学肥料に使われているとも言われています。
ハーバー・ボッシュ法が開発された20世紀初頭。
ヨーロッパは人口が急激に増加し、食糧不足の不安が高まっていました。
食糧の増産には肥料が不可欠です。
そのため、ハーバー・ボッシュ法は
水と石炭と空気からパンを作る方法
と呼ばれるに至ったのです。
ちなみに、植物は窒素源として、アンモニア態窒素だけでなく、硝酸態窒素も吸収します。
しかし、肥料として主に用いられるのはアンモニア態窒素です。
これは、硝酸態窒素が雨などですぐに流出してしまうため。
土は基本的に負の電荷を持っています。
硝酸はNO3–で同じく負の電荷。
しかし、アンモニウムイオンはNH4+で正の電荷。
土中に留まりやすいのです。
硝酸
アンモニアの増産は、硝酸の大量生産をも可能にしました。
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO
本題からずれるので、詳細はまた別の機会に回したいと思いますが、
こちらも高校化学の範囲。
オストワルト法です。
そして、硝酸は爆薬(ニトロセルロース)の原料となります。
3HNO3 + C6H10O5 → C6H7(NO2)3O5 + 3H2O
ドイツは硝石が自国内で産出せず、海外から輸入していたのですが、戦時中は当然輸入できません。
しかし、こうして国内で硝酸を生産することができるようになったため、戦争を継続できたのです。
ハーバー・ボッシュ法は、
平時には肥料を、戦時には火薬を空気から作る
とも呼ばれています。
ハーバー・ボッシュ法の課題
そんな、ハーバー・ボッシュ法。
誕生から100年以上が経過した今も現役です。
しかし、問題がないわけではありません。
それは、消費エネルギーの多さ。
高温高圧下でないと合成できないのですから当然です。
転じて、ハーバー・ボッシュ法は大量の二酸化炭素を排出しています。
世界の二酸化炭素排出量の実に1%。(引用)
地球温暖化の原因の一つとも言えるでしょう。
ハーバー・ボッシュ法の未来
そのため、研究者達はよりエネルギーを消費しないアンモニアの製造法を探しています。
その中には、日本の研究者達の姿も。
指針としては大きく二つ。
①新たな触媒の開発
②新たな方法の開発
単層カーボンナノチューブにルテニウムとセシウムを担持した触媒
①の新たな触媒の開発です。
使われているのは、単層カーボンナノチューブにルテニウムとセシウムを担持した触媒。
この触媒を用いると、
・アンモニアの濃度が1.5倍
・従来400~600℃、100~300気圧のところ、380℃、51気圧で合成
従来より、低温低圧で、濃度も1.5倍。
ネックは、ルテニウムが高価なところなどでしょうか。
コバルト触媒
①の新たな触媒の開発です。
温和な反応条件(<400℃、100気圧)でのアンモニア合成を目指したもの。
上記の条件では、ルテニウム触媒が有望視されているが、ルテニウムは高価。
そこで、より安価なコバルトを使ってみたという研究。
この触媒を用いると、
350℃、10気圧の条件で、ルテニウム系触媒を超える生成速度を確認
課題は、工業ベースに乗せられるかといったところでしょうか。
水酸化リチウムを利用した方法
水酸化リチウムを利用して、アンモニアを常圧下で合成する研究です。
合成方法は、
4LiH+N2→2Li2NH+H2
2Li2NH+4H2→2NH3+4LiH
400℃、1気圧でアンモニアを合成しようという研究。
常圧で可能というのが大きいです!
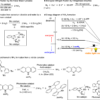
可視光エネルギーを利用した方法
常温常圧下で、可視光をエネルギー源としてアンモニアを合成しようという研究。
水素供与体として、ジヒドロアクリジン。
可視光を化学変換するための触媒として、イリジウム光酸化還元触媒。
これらを用いることで、常温常圧下において、窒素ガスN2からのアンモニア合成に成功という画期的な研究です。
個人的に、これが発表されたとき、まじか!ってなりました。
まとめ
人口増加による食糧問題。
温室効果ガスの排出による地球温暖化。
今回、アンモニアの肥料としての有用性に注目しましたが、
アンモニアを燃料として用いる研究なども進んでいます。
いずれにせよ、人類社会にアンモニアは必要不可欠。
ハーバー・ボッシュ法の改良、あるいは新たなアンモニア合成法の開発・研究が進んでいます。
最新記事 by Hitsugi-inst (全て見る)
- 国立大学のデメリット - 2023年12月3日
- 【生物】ヒトは古細菌だった!? - 2023年11月19日
- 【生物】アメボゾア(スーパーグループ) - 2023年11月5日











コメント
コメント一覧
まだ、コメントがありません
プライバシーポリシーが適用されます。